| Российский химико-аналитический
портал |
химический анализ и аналитическая химия в фокусе внимания ::: портал химиков-аналитиков ::: выбор профессионалов |
 |
|
| ANCHEM.RU » Литература » Справочные, учебные материалы / книги » ... |
Руководство по определению показателей качества воды полевыми методами » ...
В технологии выполнения химических анализов необходимым элементом является приготовление растворов химических веществ. В химическом анализе используются различные растворенные вещества (реагенты, буферные смеси, фиксирующие агенты, консерванты и т.п.) и растворители (вода, этанол и водно-спиртовые смеси, органические экстрагенты). В учебных пособиях, руководствах для химиков-аналитиков, нормативных документах (ГОСТах, РД, МУ) и справочной литературе можно встретить различные способы выражения концентраций. Ниже мы остановимся на некоторых из них, наиболее часто встречающихся, но сначала приведем краткую информацию по основополагающим единицам измерений, применяющихся при описании различных способов выражения концентраций химических веществ в растворах*.
Масса вещества обозначается как m(X) (где X – химический символ вещества) и обычно измеряется в граммах или миллиграммах.
За единицу количества вещества n(X) принят моль. Масса одного моля вещества называется молярной массой вещества. Последняя обозначается буквой «М» и обычно измеряется в г/моль. Например, М(Cu) = 63,54 г/моль, М(Н2SO4) = 98,08 г/моль.
Наряду с единицей количества вещества используется также единица количества вещества эквивалентов n[(1/z)Х], определяемая как произведение числа эквивалентности z(X) на количество вещества n(X). При этом под эквивалентом подразумевают реальную или условную частицу вещества, которая в конкретной кислотно-основной реакции эквивалентна одному иону водорода, в окислительно-восстановительной реакции – одному электрону. Соответственно, число эквивалентности z(Х) определяется исходя из химической формулы вещества и типа химической реакции:
для кислот z(Х) равно числу катионов водорода, способных замещаться катионами металлов. Например, z(НCl) = 1; z(Н2SO4) = 2;
для гидроксидов z(Х) равно числу гидроксигрупп OH–. Например, z(NaOH) = 1; z(Al(OH)3) = 3;
для солей z равно числу катионов водорода кислоты, замещенных катионами металла или аммония. Например, z(NaCl) = 1; z[Fe2(SO4)3] = 6.
Молярная масса эквивалента M[(1/z)X] есть отношение молярной массы M(X) вещества к числу эквивалентности. Например, M(1/1HCl) = 36,46/1=36,46 г/моль; M[1/6Fe2(SO4)3] = 399,88/6 = 66,65 г/моль.
Понятие «молярная масса эквивалента» равноценно прежнему «грамм-эквивалент», в современной литературе не используемому.
Молярная концентрация вещества (с) в моль/л – отношение количества растворенного вещества в молях (n) к объему раствора (V):
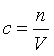
Молярная концентрация численно равна количеству молей вещества, содержащихся в 1 литре (1000 мл, 1 дм3) раствора.
Молярную концентрацию записывают следующим образом: с(НCl) = 3 моль/л; с(Н2SO4) = 2 моль/л.
Пример. Приготовление 50 мл раствора поваренной соли с молярной концентрацией 0,1 моль/л (т.е. с(NaCl) = 0,1 моль/л).
Молярная масса NaCl составляет М(NaCl) = 58 г/моль. В 1000 мл раствора с концентрацией с(NaCl)=0,1 моль/л должно содержаться n(NaCl) = 0,1 моль NaCl, или m(NaCl) = 5,8 г. В 50 мл раствора должно содержаться х г NaCl, определяемое по формуле:
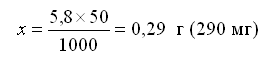
Навеску в 0,29 г следует поместить в мерную колбу на 50 мл и долить дистиллированную воду до метки. Содержимое колбы перемешивать до полного растворения соли.
Молярная концентрация эквивалента** с[(1/z)Х] есть произведение молярной концентрации с(Х) на число эквивалентности z данного вещества, т.е. с[(1/z)Х] = с(Х)×z. Молярная концентрация эквивалента показывает количество вещества эквивалентов, содержащееся в 1 л раствора.
Для многих используемых в химическом анализе растворов (KCl, HCl, NaOH и др.) молярная концентрация эквивалентов веществ совпадает с их молярной концентрацией.
Размерность молярной концентрации эквивалентов вещества записывается в виде «моль/л экв.» («ммоль/л экв.»).
Пример. Приготовление 50 мл раствора сульфата алюминия c молярной концентрацией эквивалента 1 моль/л (т.е. c[(1/z)Al2(SO4)3] = 1 моль/л экв.).
Для сульфата алюминия число эквивалентности z[Al2(SO4)3] равно 6. c[Al2(SO4)3] = 1/6 = 0, 167 моль/л.
М[Al2(SO4)3] = 342 г/моль (27 × 2 + 32 × 3 + 16 × 12 = 342); следовательно, m[Al2(SO4)3] = 342 × 0,167 = 57 г.
Составляем пропорцию: 57 г Al2(SO4)3 должно содержаться в 1000 мл раствора, х г – в 50 мл раствора:
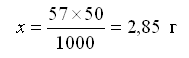
Следовательно, необходимо отвесить на весах 2,85 г Al2SO4, поместить эту навеску в мерную колбу на 50 мл и долить дистиллированную воду до метки. Содержимое колбы перемешивать до полного растворения соли.
Массовая доля (массовый процент, процентная концентрация) (w) в % – отношение массы растворенного вещества (mв) к общей массе раствора, т.е. сумме масс растворенного вещества и растворителя (mр):
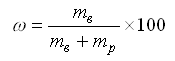
Для относительно некрепких растворов, имеющих значение плотности, близкое 1 г/см3, часто пользуются такой разновидностью массовой доли, как массовая концентрация, измеряемая в мг/л (г/л, г/дм3 т.п.).
Пример. Приготовление 50 г раствора соли с массовой долей 5% (5%-ного раствора).
В 100 г раствора содержится 5 г соли, в 50 г раствора содержится – х г соли.
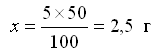
Отвесить 2,5 г соли, поместить ее в колбу (стакан) и добавить 47,5 мл воды. Перемешивать до полного растворения соли.
Мольная доля (N) – отношение числа молей данного компонента (n1) к сумме молей данного компонента и всех других компонентов раствора (растворителя и других растворенных веществ (n2):
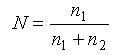
Аналогично определяется объемная доля.
Моляльная концентрация (В) в моль/кг – отношение количества растворенного вещества в молях (n) к массе растворителя (m):
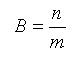
Часто встречаются также производные от единиц измерения концентраций: например, мг/л, мг/дм3, мг/см3, мг/мл, ммоль/л, г/мл (титр) и др. Наиболее употребимыми единицами в справочной литературе применительно к оценке содержания примесей в воде (например, значения ПДК) являются мг/л и ммоль/л экв.
* В настоящее время способы выражения концентраций химических веществ в международной системе единиц (СИ) приводятся в соответствии с ГОСТ 8.417-81.
** В опубликованной ранее литературе по химическому анализу и методиках выполнения измерений для выражения данного вида концентрации встречаются также имеющие те же числовые значения единицы нормальность, эквивалентная концентрация, нормальная концентрация (н., N), применявшиеся до введения ГОСТа 8.417-81.
« Назад | Содержание |
Далее »

| ЖУРНАЛ | ЛАБОРАТОРИИ | ЛИТЕРАТУРА | ОБОРУДОВАНИЕ | РАБОТА | КАЛЕНДАРЬ | ФОРУМ |
| Copyright © 2002-2022 «Аналитика-Мир профессионалов» |
Размещение рекламы / Контакты |